วัคซีนHXP–GPOVac อภ.เริ่มวิจัยในมนุษย์ระยะ 2
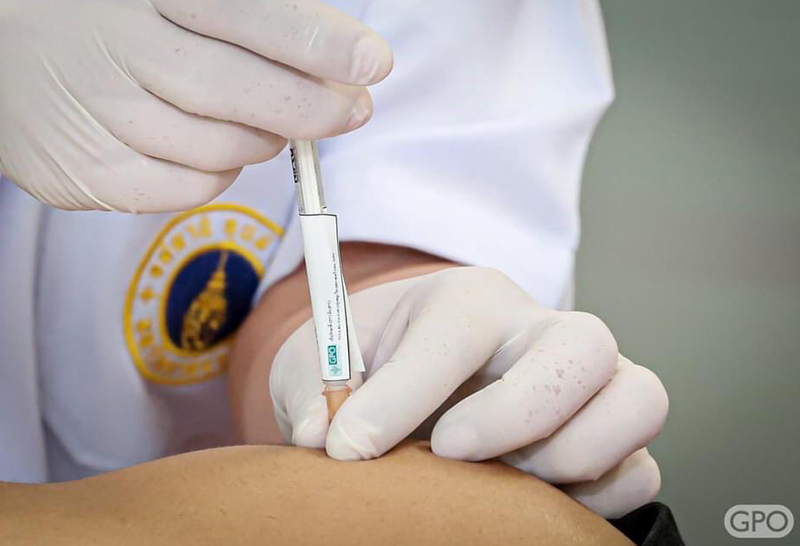
วัคซีนโควิด-19 HXP–GPOVac ขององค์การเภสัชกรรม เริ่มวิจัยในมนุษย์ระยะที่ 2 หลังระยะแรกประสบผลสำเร็จ คาดกลางปี 2565 เริ่มผลิตได้ เพิ่มความมั่นคง ลดการนำเข้า

นายแพทย์วิฑูรย์ ด่านวิบูลย์ ผู้อำนวยการองค์การเภสัชกรรม กล่าวว่า หลังจากที่องค์การเภสัชกรรมได้ดำเนินการวิจัยพัฒนากระบวนการผลิตวัคซีน และได้ทำการผลิตวัคซีนป้องกันโควิด HXP–GPOVac จนสำเร็จในขั้นแรก และนำเข้าสู่ขั้นตอนของการศึกษาวิจัยในมนุษย์ นับเป็นวัคซีนโควิดชนิดแรกของประเทศไทย ที่ได้วิจัยในมนุษย์ ซึ่งขณะนี้การศึกษาวิจัยในมนุษย์ในระยะที่ 1 ได้ผลการวิเคราะห์ภูมิคุ้มกันที่ 14 วัน หลังจากได้รับวัคซีนครบ 2 เข็มแล้ว
โดยในวันนี้ (16 สิงหาคม 2564) องค์การฯได้เริ่มทำการศึกษาวิจัยในมนุษย์ระยะที่ 2 โดยวิจัยในอาสาสมัคร จำนวน 250 คน อายุ 18-75 ปี ที่มีสุขภาพดี ไม่เคยฉีดวัคซีนป้องกันโควิดทุกชนิดมาก่อน และไม่เคยเป็นผู้ป่วยโควิดมาก่อน โดยการศึกษาวิจัยในมนุษย์ระยะที่ 1 และ 2 นี้ องค์การฯ ได้ให้คณะเวชศาสตร์เขตร้อน มหาวิทยาลัยมหิดล เป็นผู้ดำเนินการศึกษาวิจัย โดยมี ศ.พญ.พรรณี ปิติสุทธิธรรม หัวหน้าภาควิชาอายุรศาสตร์เขตร้อน รักษาการหัวหน้าศูนย์วัคซีน คณะเวชศาสตร์เขตร้อน มหาวิทยาลัยมหิดล เป็นหัวหน้าโครงการศึกษาวิจัยในมนุษย์ครั้งนี้

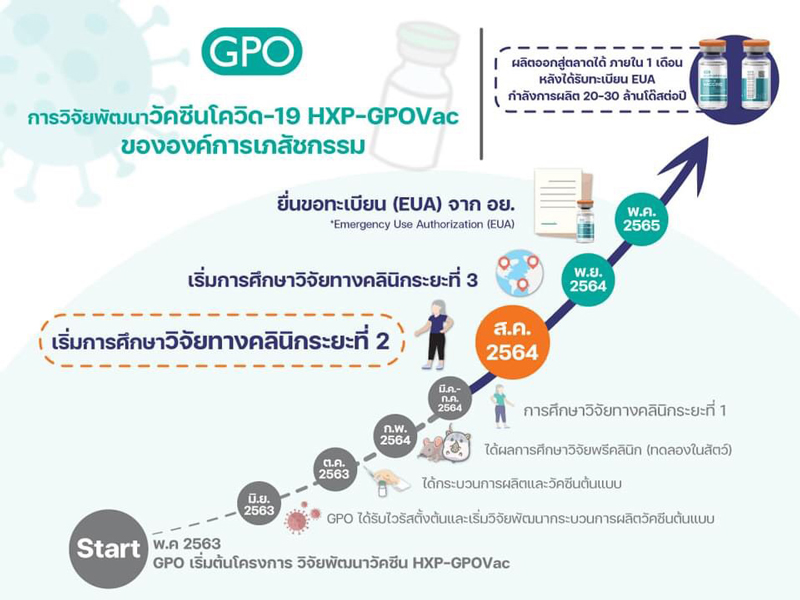
องค์การเภสัชกรรม ได้พัฒนาวัคซีน HXP–GPOVac โดยการสนับสนุนจากองค์กร PATH ที่ได้ส่งมอบหัวเชื้อวัคซีนต้นแบบซึ่งพัฒนาโดยโรงเรียนแพทย์ที่เมาท์ไซนาย (The Icahn School of Medicine at Mount Sinai) และมหาวิทยาลัยเท็กซัสที่ออสติน (University of Texas at Austin) ประเทศสหรัฐอเมริกา มาทำการผลิตที่โรงงานผลิต(วัคซีน)ชีววัตถุ ขององค์การฯ ที่ ต.ทับกวาง อ.แก่งคอย จ.สระบุรี ซึ่งได้มีการวิจัยพัฒนากระบวนการผลิตและสามารถผลิตวัคซีน HXP–GPOVac จากนวัตกรรมเชื้อตายชนิดลูกผสม (Inactivated chimeric vaccine) ผลิตด้วยเทคโนโลยีไข่ไก่ฟัก (Egg-based) เช่นเดียวกับการผลิตวัคซีนไข้หวัดใหญ่ และนำเข้าสู่กระบวนการวิจัยในมนุษย์ได้สำเร็จในระยะเวลา 10 เดือน เมื่อการศึกษาวิจัยในมนุษย์ครบทั้ง 3 ระยะและได้รับการขึ้นทะเบียนตำรับ เพื่อใช้ในกรณีฉุกเฉิน (Emergency Use Authorization, EUA) จากสำนักงานคณะกรรมการอาหารและยา (อย.) สำเร็จ คาดว่าจะเริ่มผลิตได้ในกลางปี 2565 โดยจะสามารถผลิตได้ 20-30 ล้านโดสต่อปี และจะทำการขยายกำลังการผลิตอย่างต่อเนื่อง ในเบื้องต้นนี้ “วัคซีน HXP–GPOVac” จะสามารถรองรับการฉีดเพื่อป้องกันโควิด-19 ให้ชาวไทยได้ 10-15 ล้านคน
ด้าน ดร.ภญ.พรทิพย์ วิรัชวงศ์ หัวหน้าโครงการ “วัคซีน HXP–GPOVac” องค์การเภสัชกรรม กล่าวว่า หัวเชื้อวัคซีนต้นแบบนี้ ได้พัฒนาจากนวัตกรรมการตัดต่อไวรัสนิวคาสเซิล (Newcastle disease virus, NDV) ให้มีการแสดงออกของโปรตีนหนามของไวรัสโคโรนาที่ได้ถูกปรับแต่งด้วยเทคโนโลยีเฮกซะโปร (HexaPro) ให้มีความคงตัวมากขึ้น มาใช้ในการกระตุ้นร่างกายให้สร้างภูมิคุ้มกันต้านโรคโควิด-19 เทคโนโลยีเฮกซะโปรนี้ ถูกพัฒนาที่มหาวิทยาลัยเท็กซัสที่ออสติน โดยนักวิจัยกลุ่มเดียวกับที่ได้พัฒนาโปรตีนหนามรุ่นแรกที่ใช้ในวัคซีนโควิด-19 อย่างน้อย 3 ชนิดที่มีการใช้อยู่ทั่วโลก โดยทั้งนี้องค์กร PATH ได้ส่งมอบหัวเชื้อไวรัส ให้แก่ 3 ผู้ผลิตวัคซีนในประเทศเวียดนาม ประเทศบราซิล รวมทั้งองค์การเภสัชกรรมของประเทศไทยด้วย
“วัคซีน HXP–GPOVac” นับเป็นความมั่นคง ลดการนำเข้า และเป็นการพึ่งพาตนเองด้านวัคซีนของประเทศอย่างยั่งยืน และยังส่งผลต่อความมั่นใจในการดำเนินชีวิตและการขับเคลื่อนเศรษฐกิจของสังคมไทย


ติดตามเนื้อหาดีๆแบบนี้ได้ที่
Facebook : https://www.facebook.com/innnews.co.th
Twitter : https://twitter.com/innnews
Youtube : https://www.youtube.com/c/INNNEWS_INN
TikTok : https://www.tiktok.com/@inn_news